L’équipe de Chimie Organique Multifonctionnelle
 Ce laboratoire est à la pointe de la recherche sur la chimie des sucres depuis 1964, date où son fondateur le Pr Serge David est arrivé de Nancy avec ses collaborateurs. Aujourd’hui, l’équipe dirigée par le Pr David Bonnaffé est devenue l’une des composantes de l’Institut de Chimie Moléculaire et des Matériaux d’Orsay qui regroupe plus de 250 personnes, permettant aux 9 équipes scientifiques de mettre en commun des plateformes techniques performantes. L’équipe de David Bonnaffé se compose d’enseignants-chercheurs à l’Université Paris-Sud, de chercheurs au CNRS, de techniciens et d’ingénieurs chimistes, et d’une secrétaire-gestionnaire. Avant d’être professeur, David Bonnaffé était maître de conférences à l’Université Paris-Sud où il a fait sa thèse, après une école d’ingénieur (Ecole Supérieure de Chimie Organique et Minérale à Cergy).
Ce laboratoire est à la pointe de la recherche sur la chimie des sucres depuis 1964, date où son fondateur le Pr Serge David est arrivé de Nancy avec ses collaborateurs. Aujourd’hui, l’équipe dirigée par le Pr David Bonnaffé est devenue l’une des composantes de l’Institut de Chimie Moléculaire et des Matériaux d’Orsay qui regroupe plus de 250 personnes, permettant aux 9 équipes scientifiques de mettre en commun des plateformes techniques performantes. L’équipe de David Bonnaffé se compose d’enseignants-chercheurs à l’Université Paris-Sud, de chercheurs au CNRS, de techniciens et d’ingénieurs chimistes, et d’une secrétaire-gestionnaire. Avant d’être professeur, David Bonnaffé était maître de conférences à l’Université Paris-Sud où il a fait sa thèse, après une école d’ingénieur (Ecole Supérieure de Chimie Organique et Minérale à Cergy).
Les sucres, pièces maîtresses du puzzle du vivant
La chimie du vivant est extrêmement perfectionnée, chacun le sait. Des molécules complexes comme les protéines prennent toutes sortes de formes pour assurer différentes fonctions ; l’ADN stocke en son sein toute l’information génétique, etc. Et les sucres dans tout ça ? Des sources d’énergie, certes, mais tellement plus encore !
Les sucres (ou saccharides) se déclinent sous forme d’un nombre considérable de molécules. Les nombreux sucres simples (glucose, fructose, galactose…) peuvent être les briques de molécules plus complexes : les polysaccharides. Ainsi l’assemblage de deux sucres simples : le glucose et le fructose conduit à la molécule de saccharose, « le » sucre de nos desserts préférés. Et lorsqu’un grand nombre de sucres simples s’associent, on obtient des molécules sous forme de chaînes, linéaires ou ramifiées, comme par exemple l’amidon ou la cellulose.
Saccharose ou amidon se mangent… et finissent en glucose, source d’énergie de toutes nos cellules. Mais les polysaccharides, ces sucres complexes, ne sont pas simplement des réserves énergétiques. Ce sont la matière même des plantes (la cellulose du bois est un sucre) ou bien de la carapace des crustacés ou encore de la paroi des bactéries…
Autre rôle clé des polysaccharides : la communication cellulaire. La possibilité pour une substance de pénétrer dans une cellule ou d’en modifier l’activité dépend d’un mécanisme de type clé-serrure. Les sucres forment une couche – le glycocalix – à la surface de la membrane externe des cellules animales et de certaines bactéries. Les différentes parties des polysaccharides à la surface de la cellule constituent autant de sites d’accrochage sélectifs pour telle ou telle molécule qui veut interagir avec la cellule.
Les interactions des protéines avec les polysaccharides sont particulièrement intéressantes. Les virus par exemple utilisent des protéines pour fusionner leur membrane avec celle de la cellule hôte à infecter. Certaines protéines virales s’accrochent sur des chaînes de sucre cibles à la surface de la cellule à infecter. Le système immunitaire, lui aussi, utilise des protéines pour déclencher la réponse des cellules à une infection et, là encore, les sucres jouent un rôle. Si l’on contrôle ces interactions protéine-polysaccharide, on va pouvoir soit bloquer la fonction de la protéine, soit au contraire l’activer. D’où les multiples applications : empêcher une infection par un virus, activer la réponse du système immunitaire lors d’une infection ou au contraire la freiner pour soigner certaines maladies auto-immunes, empêcher la formation de caillots de sang - certains médicaments anti-coagulants sont des sucres ! – etc.
Le savoir-faire des chimistes
Comment contrôler ces interactions ? En fabriquant des morceaux de polysaccharides, ayant exactement la bonne forme et la bonne structure pour être reconnus par la protéine concernée, ou encore des « mimes » ressemblant à ces fragments… mais plus simples à fabriquer. Et voici les chimistes en piste !
David Bonnaffé et son équipe travaillent sur les GAG (GlycosAminoGlycanes) et en particulier les héparanes sulfates (HS) qui sont des polysaccharides formés de la répétition de disaccharides sulfatés. La diversité moléculaire de ces HS est impressionnante : à partir de 48 disaccharides de base, le nombre de possibilités croît de façon exponentielle : plus de 2000 pour les tétrasaccharides (4 unités), déjà plusieurs millions pour une petite chaîne de 8 unités (octasaccharide), etc. ! Mais lequel de ces sucres ferait un bon médicament pour telle ou telle pathologie ?
Le rôle des chimistes est de synthétiser ces petites chaînes de sucre afin de les proposer aux biologistes qui les testeront. Pas question de synthétiser tous les HS possibles ! Les chimistes de l’ICMMO font des choix dans les sucres de base, élaborent des méthodes de synthèse innovantes permettant d’obtenir plusieurs composés à la fois (chimie combinatoire) et conduisent avec maestria des synthèses qui peuvent comporter jusqu’à 50 étapes ! Chaque produit est caractérisé par des techniques d’analyses pointues : RMN, chromatographie (HPLC)…
Contrôler des maladies auto-immunes
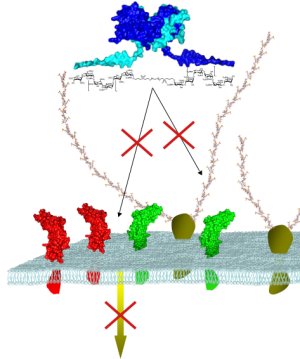
- Le polysaccharide synthétisé bloque l’action de l’interféron gamma.
- © D. Bonaffé
Pour terminer, voici un exemple prometteur, parmi d’autres, de ces recherches de pointe. La cytokine IFN-gamma est une protéine indispensable au bon fonctionnement du système immunitaire mais sa surproduction est à l’origine de graves maladies auto-immunes (polyarthrite rhumatoïde, maladie de Crohn…). Son activité est modulée grâce à l’interaction avec un polysaccharide. L’équipe de David Bonnaffé a déjà synthétisé un mime de 50mère (50 sucres) capable de s’accrocher à la protéine. Le travail consiste désormais à en trouver d’autres et à déterminer lequel sera le plus sélectif de la cytokine IFN-gamma afin de ne pas provoquer trop d’effets secondaires en s’accrochant à d’autres molécules de l’organisme.
 COMPAS - vulgarisation scientifique
COMPAS - vulgarisation scientifique