Situation énergétique actuelle
Depuis la révolution industrielle, la demande énergétique a augmenté de manière impressionnante, entrainant une forte consommation des ressources terrestres fossiles (gaz, pétrole, charbon). Après les années 1980 et l’avènement du nucléaire, la consommation d’énergie actuelle frôle les 1014kW.h par an, soit une puissance moyenne de 13 TW ! Pour se donner une idée de l’importance de cette consommation, on peut rappeler qu’un Ipod consomme 1 W, un réfrigérateur 35 W et un airbus 1 MW.
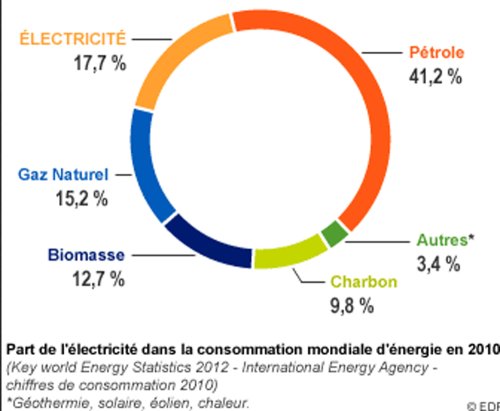
- Diagramme de la répartition de la consommation énergétique mondiale en 2010. Source EDF. * Géothermie, solaire, éolien, chaleur.
Une autre problématique actuelle est bien sûr l’impact environnemental des énergies fossiles. Le rejet excessif de CO2 et autres gaz à effet de serre dans l’atmosphère peut gravement affecter le climat terrestre par un phénomène global de réchauffement climatique (entrainant fonte de glacier, acidification des océans …).
Que faire pour réduire la facture énergétique ?
Tout d’abord, augmenter l’efficacité énergétique des systèmes électriques permettrait de nombreuses économies d’énergie, en limitant par exemple les pertes thermiques. Il faut savoir que 100 J obtenus en brûlant du charbon sont nécessaires pour alimenter en électricité une petite ampoule 25 W classique. Celle-ci perdant environ 34 J de chaleur et produisant seulement 2 J de lumière, le rendement énergétique n’est que de 2 % ! Les ampoules à incandescence, trop gourmandes, ont donc été remplacées par les lampes fluorescentes, dites « à économie d’énergie », limitant les pertes thermiques en convertissant plus efficacement l’énergie électrique en lumière visible. La seconde piste à exploiter repose sur les ressources non fossiles.En effet, les fossiles (pétrole, gaz, charbon) entraînent systématiquement un rejet de CO2 lors de leur conversion en énergie. La géothermie, l’éolien, l’hydraulique, le solaire (thermique ou photovoltaïque) produisent eux de l’énergie de façon plus « propre », limitant les rejets de gaz à effet de serre. L’inconvénient majeur de ce genre de ressources est leur intermittence ! Par définition, on ne pourra exploiter l’énergie solaire la nuit ou l’énergie éolienne lorsque le vent tombe … Il serait très avantageux de pouvoir stocker la forte production d’énergie solaire produite à midi pour l’utiliser par exemple le soir, lorsque la demande est la plus haute. Le stockage de l’électricité produite par ces énergies renouvelables est la clef de leur réel essor dans nos technologies futures.
Pas facile de stocker de l’énergie !
Le stockage a toujours été le point faible de la filière énergétique. C’est un sujet très ancien qui remonte à l’Antiquité où l’on essayait déjà de piéger de l’électricité statique par frottement dans des petites pièces en métal. Une tentative plus aboutie de stockage fut réalisée en 1746 avec la bouteille de Leyde. Ce dispositif élémentaire permettait effectivement de stocker des charges électriques, c’était le premier condensateur ! Cependant il se déchargeait beaucoup trop rapidement pour être vraiment considéré comme un stockage efficace et utile.
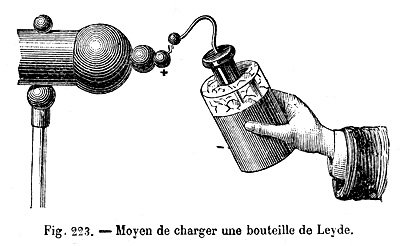

Sources : La "Nouvelle Physique" conforme aux Programmes de 1909, pour les Ecoles Primaires Supérieures de Jeunes Filles. Bouteille de Leyde, à feuilles d’or - Circa 1910.
En 1752, Benjamin Franklin s’intéresse à l’électricité et tente de dompter la foudre avec la fameuse expérience de la clef et du cerf-volant. C’est en 1800 qu’Alessandro Volta réussit véritablement à créer un stockage d’électricité « à la demande » avec la première pile.
La pile idéale ?
Une pile électrique est un dispositif transformant l’énergie d’une réaction chimique entre deux composés, un oxydant et un réducteur, en énergie électrique. L’oxydant est une espèce capable de capter un ou plusieurs électrons ; le réducteur quant à lui est une espèce donneuse d’électrons. Ces deux réactifs sont placés sur deux électrodes, respectivement à l’anode pour l’oxydant (qui correspond à la borne négative de la pile) et à la cathode pour le réducteur (à la borne positive). Ces deux électrodes sont séparées par un liquide, nommé. La réaction chimique provoque une circulation de charges (négatives et positives) assurée par l’électrolyte pour les ions et les fils extérieurs pour les électrons : un courant continu est ainsi produit jusqu’à épuisement des réactifs aux électrodes.
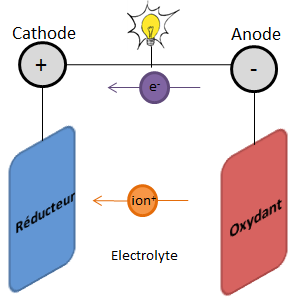
- Schéma d’une pile
Pour fabriquer une bonne pile électrique, trois aspects sont à optimiser :
![]() la force électro-motrice (f.é.m.) de la pile doit être la plus grande possible, pour avoir une puissance maximale.
la force électro-motrice (f.é.m.) de la pile doit être la plus grande possible, pour avoir une puissance maximale.
![]() la capacité de stockage d’énergie doit être très importante pour disposer d’une énergie maximale. On doit donc choisir un oxydant fort, un ion de forte valence habituellement (espèces capables d’accepter plusieurs charges), ainsi qu’un réducteur fort, un métal très souvent.
Quelques exemples : pile Leclanché Zn/MnO2, pile Al/air, pile Li/ion
Le lithium étant le métal le plus réducteur, associé à n’importe quel élément il constituera une bonne pile !
la capacité de stockage d’énergie doit être très importante pour disposer d’une énergie maximale. On doit donc choisir un oxydant fort, un ion de forte valence habituellement (espèces capables d’accepter plusieurs charges), ainsi qu’un réducteur fort, un métal très souvent.
Quelques exemples : pile Leclanché Zn/MnO2, pile Al/air, pile Li/ion
Le lithium étant le métal le plus réducteur, associé à n’importe quel élément il constituera une bonne pile !
![]() la sécurité : les métaux utilisés doivent être de faible toxicité et de faible réactivité. Le mercure, le cadmium et le plomb sont maintenant interdits dans la fabrication des batteries. La conception de la pile doit aussi minimiser les réactions parasites, comme il en existait dans la pile de Leclanché.
Zn + 2OH- + 2H2O → Zn(OH)42+ + H2
formation d’hydrogène gaz conduisant à une surpression d’où fuite de la pile possible !
la sécurité : les métaux utilisés doivent être de faible toxicité et de faible réactivité. Le mercure, le cadmium et le plomb sont maintenant interdits dans la fabrication des batteries. La conception de la pile doit aussi minimiser les réactions parasites, comme il en existait dans la pile de Leclanché.
Zn + 2OH- + 2H2O → Zn(OH)42+ + H2
formation d’hydrogène gaz conduisant à une surpression d’où fuite de la pile possible !
Pile rechargeable : la batterie
Une batterie repose sur le même principe qu’une pile, à savoir un couple oxydant / réducteur produisant une circulation de charges, à la différence près qu’ici le système chimique doit être réversible pour permettre une recharge. Les batteries les plus usitées sont celles avec du nickel et un hydrure métallique : Ni-MH (appareil photo …) et celles à base de lithium (toute l’électronique portable actuelle).
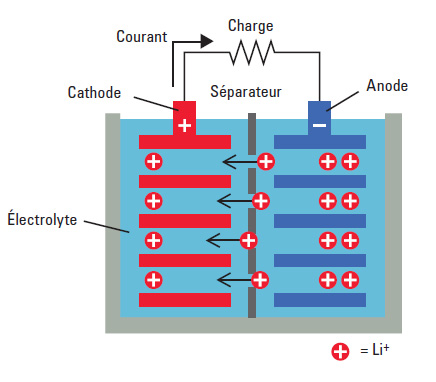
Schéma batterie Li-ion en fonctionnement. Source Vulgariz. Anode : Lithium métallique dans du graphite LiC6 Réaction d’oxydation : LiC2 → Li+ + e- +6C Cathode : oxyde permettant l’intercalation des ions Li+ Réaction de réduction : MnO2 + Li+ + e- → LiMnO2
L’anode de la batterie est constituée de lithium inséré dans du carbone ; la cathode d’oxyde de manganèse ou de cobalt. Des ions lithium Li+ générés à l’anode vont s’intercaler dans la cathode, créant ainsi une circulation de charges négatives, des électrons, dans le circuit extérieur. Le courant électrique est produit lors de la circulation de ces charges. Lors de la recharge de la batterie, le procédé s’inverse : les ions sont arrachés à la cathode et renvoyés vers l’électrode en carbone. Le temps de recharge d’une batterie dépend donc de la vitesse à laquelle les porteurs de charge (ions, et électrons) vont pouvoir se déplacer dans le dispositif. Le challenge de conception de ce type de batterie repose sur l’utilisation d’un matériau d’électrode permettant l’insertion, lors de la décharge, et l’éjection de l’ion lithium, lors de la charge. Les oxydes sont très souvent utilisés mais limitent les performances de la batterie. En effet, le lithium a du mal à s’insérer dans la structure cristalline et le courant circule donc à faible vitesse dans la batterie. Actuellement, la recherche s’oriente sur la conception de nanomatériaux pour la cathode, permettant une insertion des ions et une circulation des électrons plus rapides. Avec ce genre de batteries, la recharge est considérablement raccourcie puisque les ions lithium ont de petits trajets à effectuer dans les nanoparticules constituant les électrodes. Batterie de téléphone portable actuelle : temps de recharge 2-3 h Batterie contenant des nanomatériaux : temps de recharge 15 min
Technologies du futur ?
Depuis 1991 avec les batteries de SONY, l’énergie stockée est passée de 85 Wh/kg de batterie pour un ancien modèle à 150 Wh/kg pour une batterie au lithium nouvelle génération ! Cet énorme progrès dans le stockage d’énergie a fait le succès des batteries au lithium. On les retrouve déjà dans toute l’électronique portable et actuellement dans les voitures électriques. Les premières conceptions de voitures électriques remontent à 1899 avec la lourde batterie au plomb (1,4 T pour l’ensemble du véhicule). Par la suite, les fabricants automobiles ont longtemps misé sur une technologie hybride essence-électricité, comme pour la Toyota Prius. C’est en 2011 que le véhicule tout électrique avec une batterie Li-ion est commercialisé à grande échelle : la Blue Car. Cette petite voiture ne pèse que 0,9 T, pour 200 kg de batterie ! Cependant le problème de l’autonomie ralentit considérablement la commercialisation de ces voitures électriques (batterie Li-ion : 150 Wh/kg de batterie), au profit des voitures à essence (pétrole+air : 2500 Wh/kg d’essence, soit 15 fois plus d’énergie embarquée !).


La « jamais contente » (1988), première automobile à atteindre les 100 km/h avec un moteur électrique et la Blue Car Bolloré (2011).
De nombreux projets vont cependant généraliser l’utilisation du système Li-ion dans un futur proche. Par exemple, de petites batteries pourront être installées dans les cartes bancaires, alimentant en énergie la puce. Cela permettra non seulement la communication entre la carte et la banque mais aussi d’afficher les informations contenues dans la puce (solde bancaire …) grâce à un petit écran LCD installé sur la carte. On peut aussi imaginer de déclencher une autodestruction de la puce en cas de vol ! Ce genre de technologie est rendu possible grâce à la légèreté et la malléabilité des accumulateurs au lithium permettant de concevoir des micro batteries souples de 10 µm d’épaisseur.
Mais la batterie du futur, répondant à de grosses demandes énergétiques, comme pour une voiture, n’est pas encore au point ! Les chercheurs se penchent actuellement sur d’autres systèmes peu exploités : Zn/air, Li/S, Li/air, ou tentent de remplacer totalement le lithium. En effet, les ressources terrestres en lithium sont limitées : une estimation de 13 millions de tonnes seulement, dont la plupart se trouvent en Amérique du sud. De plus, le prix du lithium a été multiplié par 10 entre 1950 et 2000 avec l’augmentation de la demande mondiale. En jetant un coup d’œil à la table périodique des éléments, les chercheurs se sont demandés ce qu’ils pourraient faire avec du sodium ! En effet, ce proche voisin du lithium (dans la même colonne du tableau périodique) possède des propriétés similaires et est très abondant : il est présent dans l’écorce terrestre (103 ppm) et dans l’eau de mer (105 ppm). L’ion Na+ est cependant plus gros que l’ion Li+. Le challenge actuel des chimistes est donc la conception de matériaux permettant l’insertion facile et réversible du sodium dans leur structure, afin de faire fonctionner une batterie. Si l’idée semble novatrice, elle ne date pas d’hier ! Jules Verne avait dans ses romans déjà saisi les problèmes énergétiques que poseraient l’appauvrissement des ressources fossiles (L’île mystérieuse, 1874) et proposé une solution utilisant le sel marin (20 milles lieux sous les mers, 1869). De quoi inspirer les chercheurs de demain !
La fin de l’exposé laisse place aux questions des curieux du jeudi de la recherche. En particulier, nous demandons conseil sur la manière de prendre soin à la maison de nos batteries. Le Dr Sylvain Franger nous recommande de ne jamais laisser une batterie Li-ion se recharger pendant toute une nuit et d’éviter de la laisser se décharger totalement, afin, respectivement, d’éviter les réactions parasites avec l’électrolyte et de préserver la structure cristalline de la cathode. Ces conseils devraient nous permettre d’allonger de quelques années la durée de vie des batteries de nos téléphones ou ordinateurs portables. La soirée se termine par une visite au laboratoire du Dr Sylvain Franger. Il nous montre les installations permettant à son équipe de tester toutes sortes de batteries, commerciales ou de leur invention, en conditions standards ou extrêmes afin d’en évaluer les performances. Il dissèque ensuite les batteries pour en analyser tous les composants et en trouver les faiblesses. Son laboratoire est par ailleurs en collaboration avec d’autres équipes concevant de nouveaux matériaux, qu’il s’empresse de tester sur de nouvelles batteries. Nous pouvons également constater la finesse et la souplesse des micro-batteries qu’il évoquait précédemment. Il nous est alors beaucoup plus facile de les imaginer installées dans une carte bancaire !
 COMPAS - vulgarisation scientifique
COMPAS - vulgarisation scientifique