La piste de l’hydrogène
Commençons par un tout petit peu de chimie. Le principal gaz à effet de serre qui inquiète les climatologues est le dioxyde de carbone, CO2. Il résulte de la combustion de carburants contenant du carbone : le plus « polluant » d’entre eux (en terme d’effet de serre) est le charbon (carbone presque pur), le moins est le méthane (gaz naturel) : CH4 qui contient le plus faible rapport carbone/hydrogène. Un carburant propre serait l’hydrogène : H2. En brûlant dans l’oxygène de l’air, il ne donnerait que… de l’eau. Au-delà des problèmes techniques, vraisemblablement surmontables, que posent le transport et le stockage du gaz H2, la « filière hydrogène » ne pourra véritablement se développer que si les scientifiques trouvent un moyen efficace de produire ce gaz. Il n’existe pas de gisement d’hydrogène, comme il en existe de méthane (« gaz naturel ») ou de pétrole. On peut le produire en électrolysant l’eau mais cela nécessite de l’électricité : l’eau ne se décompose pas spontanément en H2 et O2 (heureusement…), il faut fournir de l’énergie. L’hydrogène ainsi obtenu est plutôt un vecteur énergétique, servant en quelque sorte à stocker l’électricité. Il existe d’autres possibilités de produire de l’hydrogène. Les cyanobactéries ou encore certaines microalgues, comme Chlamydomonas, peuvent produire de l’hydrogène dans certaines conditions en utilisant la lumière du soleil. Des bioréacteurs seront peut-être un jour développés mais les rendements faibles nécessiteraient d’y consacrer d’immenses surfaces.
La chimie de l’eau
L’idée a toutefois fait son chemin dans l’esprit des chimistes : fabriquer de l’hydrogène à partir de l’eau et d’une énergie propre, renouvelable et abondante… l’énergie solaire. Sur le papier, deux équations-bilans, établies depuis longtemps, suffisent :
![]() oxydation de l’eau : 2 H2O + énergie -> O2 + 4 H+ + 4 e-
oxydation de l’eau : 2 H2O + énergie -> O2 + 4 H+ + 4 e-
![]() réduction des protons H+ : 4 H+ + 4 e- -> 2 H2
réduction des protons H+ : 4 H+ + 4 e- -> 2 H2
La première réaction permet la séparation de charges qui fournit les électrons pour la seconde. Mais on ne sait pas encore réaliser l’oxydation de l’eau (étape 1) de façon efficace en utilisant l’énergie solaire. Des dizaines d’équipes de par le monde s’y emploient… le « graal » des chimistes comme le dit Ally Aukauloo ! Pourtant la plus modeste des plantes vertes le fait chaque jour.
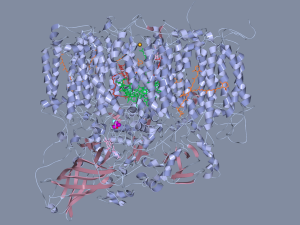
- Fig 1 : Photosystème II
- Barber et al. Science 2004
Au cours de centaines de millions d’années d’évolution, la vie a mis au point un système extrêmement sophistiqué et performant pour réaliser la photosynthèse dans des conditions « douces » (pas de chauffage, etc.). Au cœur des cellules végétales, des centres réactionnels spécifiques formés d’assemblages complexes de protéines permettent la fabrication des molécules organiques, le glucose en particulier, à partir du CO2 de l’air (réduction du carbone) et en même temps la production de l’oxygène de l’atmosphère (en oxydant l’eau). Une telle organisation pour réaliser une réaction qui semble somme toute assez élémentaire ne peut que susciter l’émerveillement. Chaque étape du processus est remarquablement optimisée : absorber la lumière, utiliser l’énergie collectée pour obtenir des électrons, les transporter vers d’autres centres réactionnels , les stocker, dissiper l’énergie en excès… Essayer de reproduire un système aussi complexe en laboratoire serait une gageure. L’étudier pour déterminer quelles en sont les pièces maîtresses et s’en inspirer pour concevoir des molécules plus simples qui pourraient être utilisées dans un processus industriel, voilà ce qu’Ally Aukauloo appelle une démarche… bio-inspirée !
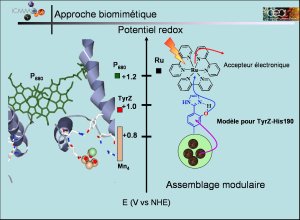
- Fig 2 : Complexe pour la photo-oxydation de l’eau
- © Ally Aukauloo
Dans les laboratoires, les chimistes élaborent et testent des assemblages modulaires capables de remplir les 3 fonctions : capter la lumière et la convertir en énergie chimique (c’est-à-dire générer une séparation de charges qui conduit à un cation et un électron), transporter les électrons, catalyser la réaction d’oxydation de l’eau (figure 2). Ces molécules sont à base de complexes dits de coordination (qui possèdent un atome métallique entouré de ligands organiques). La nature utilise les chlorophylles (pigment contenant du magnésium) pour capter et convertir l ‘énergie lumineuse et un cluster de quatre ions de manganèse pour réaliser la réaction d’oxydation de l’eau. De multiples combinaisons sont à tester pour trouver un jour le système qui effectuera l’oxydation de l’eau le plus efficacement possible.
L’autre réaction à réaliser pour obtenir l’hydrogène est la « réduction » des protons H+. Là encore, la nature possède des protéines-enzymes, les hydrogénases, capables de catalyser cette réaction. Mais si on considère simplement le site actif de cette protéine, un complexe à base de Fer, il n’est plus efficace si on le sort de sa protéine. L’équipe de l’ICMMO a développé et breveté un complexe de coordination comportant un atome de cobalt pour la réduction de l’hydrogène. Ce complexe pourrait remplacer le platine, utilisés dans l’industrie chimique pour les réactions de réduction, métal très rare et très cher.
Vers une feuille artificielle…
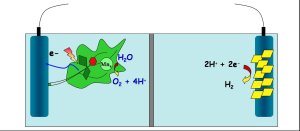
- Fig 3 : feuille artificielle
- Dans la 1/2 pile de gauche, l’eau est oxydée grâce à l’apport d’énergie lumineuse. Dans la 1/2 pile de droite, les protons sont réduits en H2. © Ally Aukauloo
Quand les deux étapes (oxydation-réduction) seront optimisées, on pourrait facilement envisager la réalisation d’une « feuille artificielle » (voir figure 3). Dans cette sorte de pile, la moitié est dédiée à l’oxydation de l’eau qui produit des électrons ; ces électrons sont alors utilisés dans l’autre moitié pour réduire les protons de l’eau et produire de l’hydrogène. Si les rendements sont suffisants, on pourrait espérer produire de l’hydrogène proprement (sans utiliser de l’électricité fabriquée par ailleurs) et sans avoir à couvrir d’immenses territoires d’algues… ou de panneaux solaires !

- Fig 4 : spectromètre RPE
- © Plateforme technique de l’ICMMO
Comme pour chaque jeudi de la recherche, la conférence a été suivie d’une longue discussion entre l’intervenant et les participants, et bien sûr d’une visite du laboratoire. Le travail du chimiste consiste non seulement à synthétiser ses molécules, mais aussi à les caractériser : l’ICMMO dispose pour cela d’une plateforme technique comportant des appareils performants. Parmi eux, les participants ont pu voir un dispositif de RPE (résonance paramagnétique électronique, fig 4) utilisé pour déterminer la structure des complexes de coordination et un magnétomètre qui permet d’établir la courbe de variation de l’aimantation d’un matériau dans un champ magnétique (utilisé pour caractériser le degré d’oxydation du manganèse à l’intérieur du complexe). Un autre type d’outils des photochimistes sont les spectromètres. Ils permettent de regarder la façon dont ces complexes absorbent la lumière et aussi d’enregistrer les modifications des spectres lorsque les réactions chimiques se déroulent.
Ainsi que l’a souligné Ally Aukauloo à l’issue de son exposé, cette recherche autour de la « photosynthèse artificielle » implique des collaborations entre de nombreuses équipes de cultures et de savoir-faire complémentaires (chimistes, physiciens, biologistes…). Elle est bien sûr internationale, avec des budgets très différents selon les pays ! Même si les feuilles artificielles ne vont pas remplacer les autres sources d’énergie dans les prochaines années, ces recherches sont essentielles pour préparer la diversification énergétique qui pourra seule assurer le développement de l’humanité à long terme...
Compte rendu écrit par Séverine Martrenchard, CNRS-CVC
 COMPAS - vulgarisation scientifique
COMPAS - vulgarisation scientifique